Daftar Isi ⇅
show
Klasifikasi materi dan perubahannya adalah pemilahan materi berdasarkan suatu karakteristik serupa dan berbagai kemungkinan perubahan wujud atau karakteristik lainnya. Benda-benda di sekitar kita dapat berupa wujud padat, cair, atau gas bukan? Semua benda tersebut adalah materi. Materi adalah sesuatu yang mempunyai massa dan dapat mengisi atau menempati suatu ruang (Tim Kemdikbud, 2017, hlm. 95).
Berdasarkan wujudnya, materi dapat diklasifikasikan menjadi zat padat, cair, dan gas. Benda padat misalnya adalah logam-logaman, zat cair meliputi air atau minyak, dan gas berupa udara, oksigen, dsb. Sementara itu, berdasarkan susunannya, materi yang ada di alam diklasifikasikan menjadi unsur, senyawa, dan campuran. Maksudnya, suatu materi dapat berarti zat tunggal atau murni (unsur), bisa juga terdiri dari beberapa zat (senyawa), hingga campuran.
Dari berbagai contoh di atas kita dapat mengetahui bahwa meskipun terlihat sederhana dan terasa sehari-hari, benda di sekeliling itu memiliki wujud dan karakteristik yang cukup rumit bukan? Untuk itulah dilakukan klasifikasi materi dan perubahannya. Untuk menyederhanakan dan mengerucutkan berbagai objek penelitian IPA agar dapat dilakukan studi yang lebih mudah dan terperinci terhadap suatu objek. Berikut adalah berbagai uraian mengenai klasifikasi materi dan perubahannya.
Cara Mengklasifikasikan Materi
Alam semesta terdiri atas planet-planet dan salah satu contohnya adalah planet bumi. Di bumi terdapat gunung, udara, laut, dan begitu banyak hal lain. Segala sesuatu yang berada di bumi tersusun atas materi, yang terdiri atas unsur, seperti air, udara, tanah, dan api. Oleh karena itu, untuk mengklasifikasikannya kita harus melakukan observasi keragaman materi tersebut.
Klasifikasi Materi
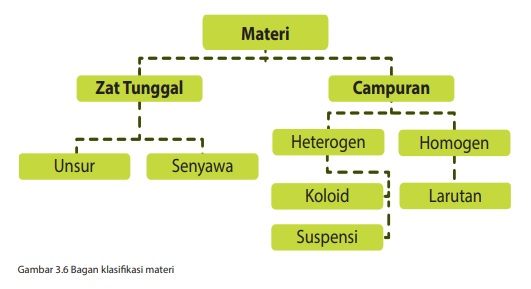
Bagaimana caranya untuk melakukan observasi terhadap berbagai keragaman materi? Langkah mudah yang dapat dilakukan untuk melakukan klasifikasi materi adalah sebagai berikut.
- Mengamati karakteristik benda tersebut.
- Mencatat persamaan dan perbedaan sifat benda masing-masing.
- Memasukkan benda-benda yang memiliki persamaan sifat ke dalam satu kelompok.
- Memberi nama yang sesuai pada setiap kelompok benda tersebut.
Salah satu klasifikasi paling mudah untuk mengklasifikasikan materi adalah berdasarkan wujudnya. Berdasarkan wujudnya, materi dapat dikelompokkan menjadi:
- Zat padat, seperti besi, seng, dan emas;
- Zat cair, yang meliputi air, minyak, dan bensin; dan
- Gas, seperti udara, asap, dan uap air.
Perbedaan masing-masing wujud materi adalah sebagai berikut.
| Padat | Cair | Gas |
|---|---|---|
| Mempunyai bentuk dan volume tertentu | Mempunyai volume tertentu, tetapi tidak mempunyai bentuk yang tetap, bergantung pada media yang digunakan. | Tidak mempunyai volume dan bentuk yang tertentu. |
| Jarak antarpartikel zat padat sangat rapat. | Jarak antarpartikel zat cair lebih renggang. | Selisih jarak antarpartikel gas sangat renggang. |
| Partikel-pertikel zat padat tidak dapat bergerak bebas. | Partikel-pertikel zat cair dapat bergerak bebas, namun terbatas. | Partikel-partikel gas dapat bergerak dengan sangat bebas. |
Unsur, Senyawa, dan Campuran
Berdasarkan susunannya, materi yang ada di alam dapat diklasifikasikan menjadi zat tunggal (unsur/senyawa), dan campuran. Apa maksud dari zat tunggal (unsur/senyawa), dan campuran? Berikut adalah penjelasan lengkapnya.
Unsur
Unsur adalah zat tunggal yang tidak dapat dibagi lagi menjadi bagian yang lebih sederhana dengan proses kimia biasa dan akan tetap mempertahankan karakteristik asli dari unsur tersebut (Tim Kemdikbud, 2017, hlm. 98). Misalnya, sebongkah emas apabila dibagi terus sampai bagian yang terkecil akan menjadi atom emas. Atom adalah bagian terkecil dari suatu unsur. Contoh unsur lain meliputi: besi, timah, seng, tembaga, dan nikel.
Para ilmuwan menggunakan simbol tertentu untuk setiap unsur untuk mempermudah persamaan matematisnya. Berikut adalah beberapa contoh unsur logam dan non logam disertai simbolnya.
Unsur Logam dan Lambangnya
| No. | Nama Latin | Nama Indonesia | Lambang |
|---|---|---|---|
| 1. | Aluminium | Aluminium | AI |
| 2. | Aurum | Emas | Au |
| 3. | Argentum | Perak | Ag |
| 4. | Calcium | Kalsium | Ca |
| 5. | Cuprum | Tembaga | Cu |
| 6. | Ferrum | Besi | Fe |
| 7. | Natrium | Natrium | Na |
| 8. | Plumbum | Timbal | Pb |
| 9. | Stannum | Timah | Sn |
Unsur Nonlogam dan Lambangya
| No. | Nama Latin | Nama Indonesia | Lambang |
|---|---|---|---|
| 1. | Oxygen | Oksigen | O |
| 2. | Hydrogen | Hidrogen | H |
| 3. | Carbon | Karbon | C |
| 4. | Sulphur | Belerang | S |
| 5. | Phosphorus | Fosfor | P |
| 6. | Nitrogen | Nitrogen | N |
| 7. | Iodium | Iodin | I |
Unsur logam dan nonlogam memiliki perbedaan sifat fisika dan kimia. Berikut perbedaan sifat unsur logam dan nonlogam.
| Unsur Logam | Unsur Nonlogam |
|---|---|
| 1. Berwujud padat pada suhu kamar (kecuali raksa). | 1. Ada yang berwujud padat, cair, dan gas. |
| 2. Dapat ditempa dan dapat diregangkan. | 2. Bersifat rapuh dan tidak dapat ditempa. |
| 3. Konduktor listrik dan panas. | 3. Nonkonduktor, kecuali grafit. |
Baik unsur logam maupun nonlogam memiliki banyak kegunaan dalam kehidupan sehari-hari. Contohnya besi dan tembaga, banyak digunakan untuk alat-alat perkakas, alat-alat rumah tangga, dan bahan untuk rangka kendaraan. Unsur Iodium banyak digunakan sebagai antiseptik.
Cara Penamaan dan Lambang Unsur
Unsur diberi nama dengan menggunakan bahasa Latin berdasarkan penemu pertamanya atau tempat ditemukannya unsur tersebut. Ahli-ahli kimia tidak membedakan penamaan unsur alamiah yang terdapat di alam ataupun unsur buatan. Beberapa unsur menggunakan nama untuk menghormati identitas penemunya ataupun tempat penemuannya.
Simbol unsur dibuat untuk memudahkan dalam penulisan nama unsur, yaitu dengan cara menyingkatnya. Simbol unsur yang saat ini digunakan secara internasional adalah simbol unsur yang diusulkan oleh Jöns Jacob Berzelius.
Cara pemberian lambang unsur menurut Berzelius adalah sebagai berikut.
- Setiap unsur dilambangkan dengan satu huruf, yaitu huruf awal dari nama latinnya.
- Huruf awal ditulis dengan huruf kapital atau huruf besar.
- Untuk unsur yang memiliki huruf awal sama, diberikan satu huruf kecil dari nama unsur tersebut (Tim Kemdikbud, 2017, hlm. 99).
Contohnya: Karbon (nama latinnya Carbon), dilambangkan dengan (C), Kalsium (nama latinnya Calsium) dilambangkan dengan (Ca).
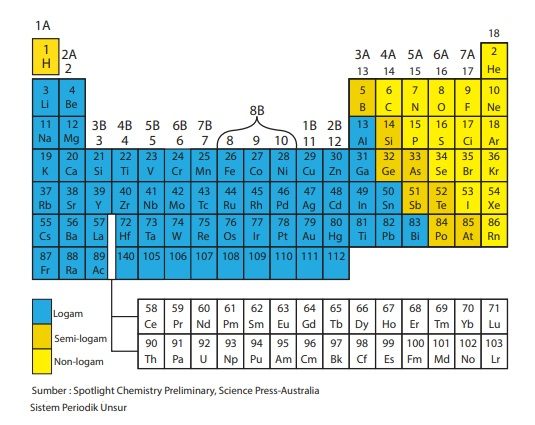
Tabel Sistem Periodik Unsur
Unsur-unsur tersebut selanjutnya disusun dalam bentuk sistem periodik unsur. Unsur-unsur yang memiliki sifat yang hampir sama diletakkan dalam satu kolom. Berbagai unsur-unsur logam terletak di bagian kiri bawah (diberi simbol warna biru), unsur-unsur nonlogam terletak di bagian kanan atas (diberi simbol warna kuning), sedangkan unsur semilogam (diberi warna cokelat) di antara warna biru dan kuning. Untuk lebih jelasnya, berikut adalah tabel sistem perioduk unsur.
Senyawa
Senyawa adalah zat tunggal/murni yang dapat diuraikan secara kimia menjadi dua zat atau lebih (Tim Kemdikbud, 2017, hlm. 102). Dalam kehidupan sehari-hari, kita sering menggunakan beragam senyawa, meliputi: air, gula, garam, asam cuka, dan beberapa bahan lainnya. Dua atau lebih atom dapat bergabung melalui reaksi kimia dan membentuk molekul. Molekul merupakan bagian terkecil dari suatu senyawa.
Contoh pembentukan senyawa meliputi adalah, air yang memiliki rumus H2 O dapat diuraikan menjadi unsur hidrogen (H) dan oksigen (O). Senyawa terbentuk melalui proses pencampuran unsur secara kimia. Sifat suatu senyawa akan berbeda dengan sifat unsur- unsur penyusunnya. Misalnya, sifat air sebagai senyawa akan berbeda dengan sifat gas hidrogen dan oksigen sebagai unsur penyusunnya.
Pada suhu kamar air berwujud cair, sedangkan hidrogen dan oksigen, keduanya berwujud gas. Air dapat digunakan untuk memadamkan api, sedangkan gas hidrogen merupakan zat yang mudah terbakar dan gas oksigen merupakan zat yang diperlukan dalam pembakaran.
Campuran
Campuran adalah suatu materi yang terdiri atas dua zat atau lebih yang masih mempunyai sifat zat asalnya dan tidak mempunyai komposisi yang tetap. (Tim Kemdikbud, 2017, hlm. 103). Contoh beberapa campuran dalam kehidupan sehari-hari adalah susu cokelat, air sungai, udara, batuan, garam beryodium, dan paduan logam.
Campuran adalah suatu materi yang terdiri atas dua zat atau lebih yang masih mempunyai sifat zat asalnya. Terdapat dua jenis campuran, yaitu campuran homogen dan campuran heterogen.
Campuran Homogen
Campuran homogen adalah campuran yang tidak dapat dibedakan zat-zat yang tercampur di dalamnya. Larutan gula, larutan garam, dan sirop merupakan contoh campuran homogen. Hal itu berbeda dengan campuran heterogen seperti air dan pasir yang masih dapat dibedakan keduanya (tidak larut).
Oleh karena itu, campuran homogen juga sering disebut sebagai larutan. Larutan tersusun atas pelarut (solvent) dan zat terlarut (solute). Pelarut yang banyak digunakan adalah air. Senyawa lain yang dapat digunakan sebagai pelarut adalah senyawa organik yang dikenal juga sebagai pelarut organik , contohnya kloroform dan alkohol.
Dalam larutan, ukuran partikel zat terlarut sangat kecil dengan diameter kurang dari 1 nm sehingga partikel zat terlarut tidak dapat dilihat walaupun menggunakan mikroskop ultra. Oleh karena itu, larutan terlihat homogen (serba sama).
Pada dasarnya, larutan yang dikenal dalam kehidupan sehari-hari dapat dikelompokkan menjadi larutan yang bersifat asam, basa, atau garam.
Larutan Asam
Larutan asam dan basa dimanfaatkan secara luas untuk industri, pertanian, kesehatan, dan penelitian di laboratorium. Salah satu contoh larutan asam adalah penambah rasa makanan, yaitu cuka dapur yang mengandung asam asetat. Contoh lainnya adalah aki pada kendaraan bermotor mengandung asam sulfat, kemudian asam klorida yang membantu sistem pencernaan manusia. Masih banyak lagi contoh larutan asam lainnya, untuk mengetahuinya, berikut adalah ciri atau tanda dari larutan asam.
- Rasanya masam (tidak boleh dicoba kecuali dalam makanan).
- Dapat menimbulkan korosi.
- Mengubah kertas lakmus biru menjadi merah.
Larutan Basa
Basa adalah larutan yang banyak dijumpai dalam kehidupan sehari-hari. Contoh benda yang mengandung basa ialah sabun mandi, sabun cuci, sampo, pasta gigi, obat mag, dan pupuk. Dalam penggunaan sehari-hari, umumnya basa dicampur dengan zat lain.
Bagaimana cara kita mengidentifikasi larutan basa? Berikut adalah sifatsifat basa.
- Mempunyai rasa agak pahit (tidak boleh dicoba).
- Terasa licin di kulit.
- Mengubah kertas lakmus merah menjadi biru.
Dalam kehidupan sehari-hari, larutan asam sering direaksikan dengan larutan basa untuk menghasilkan senyawa netral atau dikenal dengan reaksi netralisasi. Pada reaksi netralisasi ini akan dihasilkan garam dan air.
Contoh penerapan reaksi netralisasi dalam kehidupan sehari-hari adalah untuk pengobatan bagi penderita sakit mag. Di mana sakit mag (kondisi kadar asam lambung yang tinggi) maka obat mag adalah senyawa yang bersifat basa (kandungannya magnesium hidroksida atau aluminium hidroksida).
Garam
Jenis senyawa garam yang paling dikenal adalah garam dapur atau nama senyawa kimianya natrium klorida (NaCl). Garam seperti yang telah kita ketahui banyak digunakan dalam pengolahan makanan. Contoh lain dari penggunaan garam lainnya meliputi untuk industri pupuk, obat-obatan, pengolahan makanan, dan bahan pengawet.
Bagaimana senyawa garam dapat terbentuk? Salah satu reaksi yang dapat membentuk garam adalah reaksi asam dan basa atau reaksi netralisasi. Pada reaksi netralisasi tersebut akan dihasilkan garam dan air. (Asam + Basa -> Garam + Air).
Campuran Heterogen
Berbeda dengan larutan gula, pada campuran pasir dan air, tentu kamu dapat membedakan antara pasir dan air. Campuran pasir dan air merupakan salah satu contoh dari campuran heterogen. Campuran heterogen adalah campuran yang terjadi karena zat yang tidak dapat bercampur satu dengan lain secara sempurna sehingga masih dapat dikenali zat penyusunnya.

Pada campuran heterogen, seluruh bagiannya tidak memiliki komposisi yang sama (tidak serba sama). Contoh lainnya dari campuran heterogen adalah pada air dan minyak yang jelas-jelas tidak dapat bersatu atau larut.
Cara Memisahkan Campuran
Untuk memperoleh zat murni, penyusun campuran tersebut harus dipisahkan. Zatzat dalam campuran tersebut dapat dipisahkan secara fisika. Prinsip pemisahan campuran didasarkan pada perbedaan sifat-sifat fisis zat penyusunnya, seperti wujud zat, ukuran partikel, titik leleh, titik didih, sifat magnetik, kelarutan, dan lain sebagainya.
Mengapa kita ingin memisahkan campuran? Metode pemisahan campuran banyak digunakan dalam kehidupan sehari-hari seperti untuk penjernihan air dan pembuatan garam, menghilangkan rasa tertentu, memisahkan suatu zat berbahaya agar dapat dikonsumsi, dsb. Beberapa metode pemisahan campuran yang sering digunakan antara lain penyaringan (filtrasi), sentrifugasi, sublimasi, kromatografi, dan distilasi.
Filtrasi (Penyaringan)
Salah satu metode pemisahan yang paling sederhana adalah metode filtrasi atau dengan kata lain melakukan penyaringan. Prinsip kerja penyaringan didasarkan pada perbedaan ukuran partikel zatzat yang bercampur, umumnya untuk memisahkan padatan dari cairan.
Alat utama yang digunakan dalam penyaringan adalah penyaring dari bahan berpori yang dapat dilalui partikel-partikel kecil, tetapi menahan partikel yang lebih besar.
Sentrifugasi
Metode sentrifugasi sering dilakukan sebagai pengganti filtrasi jika partikel padatan yang terdapat dalam campuran memiliki ukuran sangat halus dan jumlah campurannya lebih sedikit. Metode sentrifugasi digunakan secara luas untuk memisahkan sel-sel darah merah dan sel-sel darah putih dari plasma darah. Dalam hal ini, padatan adalah sel-sel darah merah dan sel-sel darah putih yang akan mengumpul di dasar tabung reaksi, sedangkan plasma darah berupa cairan yang berada di bagian atas.
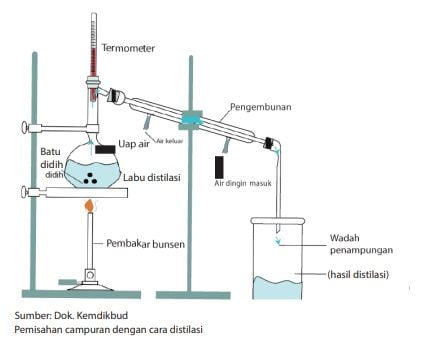
Distilasi (Penyulingan)
Pemisahan campuran dengan cara penyulingan biasanya digunakan untuk memisahkan suatu zat cair dari campurannya. Prinsip kerjanya didasarkan pada perbedaan titik didih dari zat cair yang bercampur, sehingga saat menguap setiap zat akan terpisah.
Kromatografi
Prinsip kerja kromatografi didasarkan pada perbedaan kecepatan merambat antara partikel-partikel zat yang bercampur dalam suatu medium diam ketika dialiri suatu medium gerak. Metode pemisahan dengan cara kromatografi digunakan secara luas dalam berbagai kegiatan. Di antaranya untuk memisahkan berbagai zat warna dan tes urine untuk seseorang yang dicurigai menggunakan obat terlarang (doping), hingga mengidentifikasi hasil pertanian yang tercemar oleh pestisida atau tidak.
Sublimasi
Prinsip kerja metode pemisahan campuran dengan cara sublimasi didasarkan pada campuran zat yang memiliki satu zat yang dapat menyublim (perubahan wujud padat ke wujud gas) sedangkan zat yang lainnya tidak dapat menyublim. Contohnya, campuran iodin dengan garam dapat dipisahkan dengan cara sublimasi.
Benda-benda yang dapat Mengalami Perubahan
Benda-benda yang kita kenal dalam kehidupan sehari-hari seringkali mengalami perubahan. Perubahan tersebut ada yang bersifat langsung dapat diamati, namun ada juga yang memerlukan waktu lama untuk pengamatannya.
Perubahan benda-benda tersebut dikenal dengan perubahan materi. Contoh perubahan materi yang berlangsung cepat adalah pembakaran kertas. Sedangkan contoh perubahan materi yang memerlukan waktu yang relatif lama ialah proses berkaratnya besi.
Sifat-sifat benda secara garis besar dibedakan menjadi dua, yaitu sifat fisika dan sifat kimia.
- Sifat fisika adalah sifat yang berkaitan dengan keadaan fisik suatu zat. Sifat fisika termasuk di dalamnya bentuk, warna, bau, kekerasan, titik didih, titik beku, titik leleh, daya hantar, ukuran partikel, dan massa jenis (densitas).
- Sementara itu, sifat kimia adalah sifat zat yang berhubungan dengan mudah atau sukarnya zat tersebut untuk bereaksi secara kimia.
Berdasarkan sifat benda tersebut, perubahan suatu materi dapat berlangsung melalui 2 cara, yaitu perubahan fisika dan perubahan kimia.
Perubahan Fisika
Perubahan fisika adalah perubahan zat yang tidak disertai dengan terbentuknya zat baru (Tim Kemdikbud, 2017, hlm. 124). Komposisi materi yang berubah secara fisika juga tidak akan berubah, misalnya es yang mencair. Baik dalam bentuk padat maupun dalam bentuk cair keduanya tetaplah air, yakni H2O. Contoh perubahan fisika lainnya adalah menguap, mengembun, mencair, membeku, menyublim, melarut, serta perubahan bentuk (fisik) lainnya.
Contoh perubahan fisika lainnya meliputi:
- kayu diubah menjadi kursi,
- beras diubah menjadi tepung beras,
- gula dilarutkan dalam air,
- bola lampu listrik menyala,
- air berubah menjadi es.
Perubahan Kimia
Perubahan kimia adalah perubahan zat yang dapat menghasilkan atau membentuk zat baru dengan sifat kimia yang berbeda dengan zat asalnya (Tim Kemdikbud, 2017, hlm. 125). Perhatikan kayu yang dibakar, apakah kayu sebelum dan setelah dibakar akan menghasilkan zat yang sama? Jawabannya tentu tidak.
Kayu sebelum dibakar mengandung serat selulosa, tetapi setelah dibakar berubah menjadi arang atau karbon. Dengan demikian, pada proses pembakaran kayu diperoleh zat baru yang memiliki sifat berbeda dengan zat sebelumnya. Proses pembakaran kayu yang mengakibatkan terbentuknya zat baru merupakan salah satu contoh perubahan kimia.
Contoh lain perubahan kimia yang sering terjadi di alam adalah proses perkaratan besi. Besi sebelum berkarat merupakan unsur Fe, tetapi besi setelah berkarat berubah menjadi senyawa Fe2 O3 . nH2O.
Berlangsungnya perubahan kimia dapat diketahui dengan ciri-ciri sebagai berikut.
- Terbentuknya zat baru.
- Terbentuk gas.
Contoh reaksi kimia yang membentuk gas ialah reaksi logam magnesium (Mg) dengan asam klorida (HCl). Reaksi tersebut dapat ditulis sebagai berikut. Magnesium + Asam klorida -> Magnesium klorida + gas hidrogen - Terbentuknya endapan.
Salah satu contoh reaksi yang dapat membentuk endapan ialah reaksi antara barium klorida (BaCl2 ) dengan natrium sulfat (Na2 SO4 ) menghasilkan endapan barium sulfat berwarna putih. - Terjadinya perubahan warna.
Contoh reaksi kimia yang memberikan warna yang khas adalah reaksi antara tembaga sulfat (CuSO4 ) dengan air (H2O). Warna tembaga sufat adalah putih, apabila ditambahkan air, warnanya berubah menjadi biru. Warna biru tersebut adalah warna senyawa baru yang terbentuk, yaitu CuSO4 .5H2 - Terjadinya perubahan suhu.
Contoh perubahan Kimia yang terjadi di alam meliputi:
- pembakaran kayu menjadi arang,
- singkong menjadi tapai,
- makanan basi,
- susu diubah menjadi keju,
- besi menjadi berkarat.
Perbedaan Perubahan Fisika dan Kimia
Dengan berbagai pemaparan di atas, dapat disimpulkan bahwa perbedaan perubahan fisik dan kimia adalah sebagai berikut:
| Perubahan Fisika | Perubahan Kimia |
|---|---|
| Tidak terbentuk zat baru. | Terbentuk zat baru. |
| Komposisi materi tidak berubah. | Komposisi materi sebelum dan sesudah reaksi mengalami perubahan atau perbedaan. |
Referensi
- Kementerian Pendidikan dan Kebudayaan. (2017). Ilmu Pengetahuan Alam SMP/MTs Kelas VII. Jakarta: Kementerian Pendidikan dan Kebudayaan.

Oke siap
Sesuai dengan alamat dan nomor tlp/hp yang kita miliki.
Ini di suruh ringkas y pak
Terima kasih.
oke ton
Singkar padat dan jelas