Daftar Isi ⇅
show
Sejatinya seluruh benda dan makhluk hidup di dunia ini tersusun dari satuan-satuan partikel yang sangat kecil. Partikel-partikel tersebut bersusun sedemikian rupa membentuk berbagai kebutuhan dari masing-masing benda atau makhluk.
Misalnya, sel yang sudah kecil sekalipun ternyata terbentuk dari kumpulan molekul. Molekul sendiri sebetulnya terbentuk dari kumpulan atom. Atom sendiri masih tersusun dari partikel yang lebih kecil lainnya.
Partikel penyusun atom adalah Inti atom dan awan elektron yang mengelilinginya. Sementara itu, penyusun inti atom adalah proton yang bermuatan positif dan neutron yang bermuatan netral. Namun, untuk mendapatkan konklusi sementara yang ajeg, mari kita sebut bahwa atom adalah satuan terkecil dari seluruh materi.
Mengapa? Karena atomlah yang merupakan penyusun molekul-molekul yang menyusun seluruh benda dan makhluk hidup di alam ini. Lalu sebetulnya apa saja partikel-partikel pembentuk alam ini? Seperti apa pembentukannya, dan bagaimana detail penyusunannya? Berikut adalah penjelasan lengkapnya, di mulai dari pemaparan partikel itu sendiri.
Partikel Penyusun Benda dan Makhluk Hidup
Partikel adalah bagian terkecil dari suatu materi yang masih mempunyai sifat materi itu sendiri. Partikel dapat berbentuk atom, molekul, dan ion. Pertama, kita harus mengetahui subjek utama dari partikel penyusun benda dan makhluk hidup, yakni atom.
Atom
Atom adalah satuan dasar materi atau bagian terkecil dari suatu unsur yang masih memiliki sifat unsur tersebut. Namun seperti yang telah dijelaskan sebelumnya, atom sendiri ternyata tersusun dari bagian yang lebih kecil lagi yang disebut partikel subatom.
Partikel Subatom
Atom tersusun atas partikel-partikel penyusun atom atau partikel subatom, yaitu neutron (n), proton (p), dan elektron (e). Berikut adalah penjabaran dari subatom:
- Neutron dan proton membentuk inti atom.
- Elektron menempati kulit-kulit atom yang ada di sekitar inti atom. Elektron-elektron tersebut bergerak mengelilingi inti dengan kecepatan tinggi membentuk awan elektron. Peranan elektron adalah membantu pembentukan ikatan kimia antaratom dalam suatu molekul yang nantinya dibentuk oleh atom.
Untuk lebih jelasnya, perhatikan bagaimana partikel subatom membentuk atom pada gambar di bawah ini.
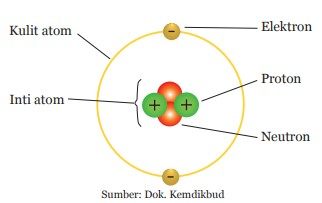
Elektron dan proton merupakan partikel subatom yang mempunyai muatan berlawanan, sedangkan neutron tidak bermuatan. Elektron memiliki muatan negatif sedangkan proton memiliki muatan positif.
Massa Subatom
Setiap partikel penyusun subatom mempunyai massa. Elektron mempunyai massa sangat kecil dibandingkan dengan massa proton dan neutron. Oleh sebab itu massa atom akan terpusat pada inti atom saja atau ditentukan oleh jumlah proton dan jumlah neutronnya.
Energi Subatom
Menurut Bohr (dalam Tim Kemdikbud, 2017, hlm. 108) atom mempunyai kulit-kulit atom tempat elektron bergerak mengelilingi inti atom. Kulit atom yang paling dekat dengan inti atom mempunyai energi paling rendah. Sementara kulit atom yang lebih jauh dari inti atom mempunyai energi yang lebih tinggi.
Elektron yang berada pada kulit atom paling dalam dapat berpindah ke kulit atom yang lebih luar bila menyerap energi dari luar atom. Energi itu dapat berasal dari panas pembakaran atau dari energi listrik yang melewati atom-atom tersebut. Elektron yang terletak pada kulit atom paling luar akan mendapatkan gaya tarik yang lemah dari inti atom.
Oleh karena itu elektron pada kulit atom paling luar mudah lepas dari kulit itu, sehingga atom dapat kehilangan elektron.
Aplikasi/Pemanfaatan Subatom
Selain peranan elektron yang membantu pembentukan ikatan kimia antaratom dalam suatu molekul, elektron juga diaplikasikan menjadi mikroskop elektron. Mikroskop elektron adalah alat yang dapat digunakan untuk melihat benda yang berukuran sangat kecil, misalnya virus atau organel sel.
- Mikroskop elektron dapat melakukan perbesaran dari 1.000 hingga 1 juta kali yang berarti jauh lebih besar dari mikroskop biasa. Hal tersebut memungkinkan akibat dari berkas elektron digunakan sebagai pengganti cahaya.
- Selain itu, elektron juga dimanfaatkan untuk teknologi Sinar-X untuk melihat tulang tanpa membedah tubuh manusia. Sinar-X adalah radiasi elektromagnetik yang memiliki panjang gelombang pendek (1-10 m) dan dihasilkan dari elektron-elektron yang tereksitasi dalam atom yang kemudian meloncat dari kulit atom luar ke kulit atom yang lebih dalam.
Nomor Atom dan Nomor Massa
Atom-atom dari unsur yang berbeda memiliki jumlah partikel subatom yang berbeda. Semua atom dalam suatu unsur yang sama memiliki jumlah proton yang sama di dalam intinya. Jumlah proton ini unik untuk setiap unsur dan dijadikan sebagai dasar nomor atom. Sementara nomor massa suatu atom ditentukan oleh jumlah neutron dan proton.
Atom yang satu berbeda dengan atom yang lain karena mempunyai jumlah elektron, proton, dan neutron yang berbeda. Jika dua atom mempunyai massa atom berbeda, maka jari-jari kedua atom itu akan berbeda pula.

Oleh sebab itu, pada gambar di atas, atom H, O, dan C mempunyai ukuran yang berbeda. Hubungan nomor atom, nomor massa, dan jumlah neutron dalam suatu atom yang netral (tidak bermuatan) dapat dituliskan dengan persamaan berikut.
Nomor atom = Jumlah proton (p) = jumlah elektron (e)
Nomor massa = Jumlah proton (p) + Jumlah neutron (n)
Setiap unsur dituliskan dengan lambang unsur. Pada penulisan lambang unsur, nomor atom ditulis sebagai subscript (turun) di kiri lambang unsur, sedangkan nomor massa ditulis sebagai superscript (naik) di kiri atas lambang unsur, seperti pada gambar di bawah ini.
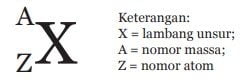
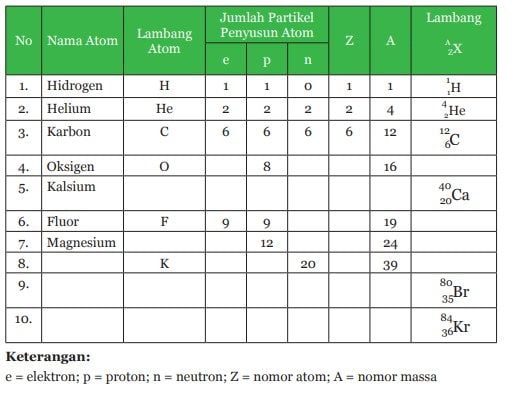
Sebagai contoh, penulisan lambang unsur litium (Li) yang mempunyai nomor atom 3 dan nomor massa 7 adalah 7 3Li. Berikut ini adalah Tabel Periodik untuk menentukan jumlah proton, neutron, elektron, dan nomor massa suatu atom.
Prinsip Pembentukan Molekul dan Ion
Sebelum atom bergabung dan membentuk molekul, terdapat berbagai pementukan ikatan fisika dan kimia yang terjadi dalam atom dan partikel pembentuknya sendiri. Salah satunya adalah konfigurasi elektron.
Konfigurasi Elektron
Susunan elektron di dalam suatu atom disebut dengan konfigurasi elektron. Seperti yang telah dijelaskan pada model atom Bohr, elektron bergerak mengelilingi inti atom menurut tingkat-tingkat energi tertentu yang disebut sebagai kulit-kulit atom.
Tingkat energi dalam suatu atom berturut-turut dilambangkan dengan K untuk kulit atom pertama (n=1), L untuk kulit atom kedua (n=2), M untuk kulit atom ke tiga (n=3), dan seterusnya.
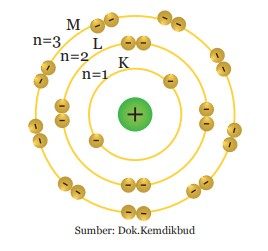
Suatu atom akan mempunyai kulit K, kulit L, kulit M, dan seterusnya. Tiap-tiap kulit atom ditempati oleh sejumlah elektron. Setiap kulit mempunyai jumlah maksimum elektron yang dapat menempatinya. Misalnya kulit K, maksimum hanya dapat ditempati oleh 2 elektron.
Apabila atom tersebut mempunyai elektron lebih dari 2 maka elektron berikutnya akan menempati kulit yang berikutnya. Posisi elektron pada kulit-kulit atom dimulai dari kulit terdalam atau yang mempunyai energi paling rendah.
Di bawah ini adalah penjabaran tingkat energi, lambang kulit atom, dan jumlah elektron maksimal yang dapat menempatinya.
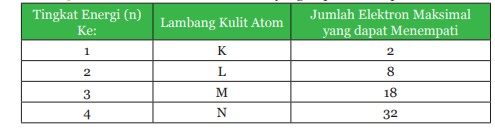
Berdasarkan tabel di atas, perhatikan jumlah elektron pada tiap-tiap kulit beberapa atom pada tabel di bawah ini.
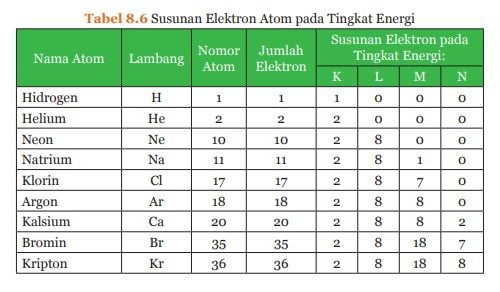
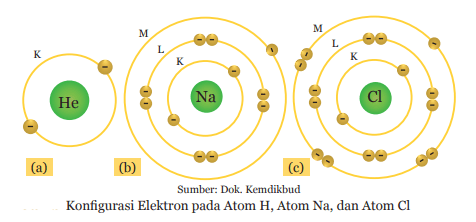
Posisi elektron secara berurutan dimulai dari kulit K, kemudian ke kulit atom yang lebih tinggi. Pada contoh di atas, atom helium (He), natrium (Na), dan klor (Cl), mempunyai konfigurasi elektron sesuai dengan urutan jumlah elektron yang dapat menempati kulit K, L, dan M.
Pada atom Kalsium (Ca) yang mempunyai 20 elektron, kulit atom K dan L berturut-turut ditempati oleh 2 dan 8 elektron sehingga tersisa 10 elektron. Walaupun kulit M dapat ditempati 18 elektron, tetapi jumlah elektron yang tersisa hanya 10, maka sebanyak 8 elektron akan menempati kulit M terlebih dahulu dan 2 elektron akan menempati kulit N.
Hal ini disebabkan penempatan 8 elektron pada kulit M dan 2 elektron pada kulit N lebih stabil dibandingkan penempatan 10 elektron sekaligus pada kulit M. Apabila jumlah elektron yang tersisa setelah K dan L lebih dari 18 elektron maka kulit atom M akan ditempati 18 elektron.
Contoh Konfigurasi Elektron
Perhatikan contoh konfigurasi atom bromin dan kripton. Intinya, elektron akan berada pada setiap kulit hingga membentuk susunan yang paling stabil.
Ion dan Ikatan Ion
Ion adalah atom atau molekul yang memiliki jumlah total elektron yang tidak sama dengan jumlah total protonnya. Bila jumlah elektron dan jumlah proton dalam suatu atom tidak sama, atom tersebut akan bermuatan atau menjadi ion. Proses pembentukan ion itu disebut ionisasi.
Ion yang bermuatan positif disebut kation, sedangkan ion yang bermuatan negatif disebut anion. Gaya tarik-menarik antara kation dan anion dalam senyawa tersebut disebut ikatan ionik.
Manusia tidak akan dapat hidup tanpa adanya ion-ion. Contohnya adalah fungsi ion kalsium (Ca2+) pada sistem peredaran darah manusia. Ion kalsium sangat penting dalam pembekuan darah, ketika terjadi luka pada tubuh kita. Tanpa ion kalsium, saat tubuh luka, maka darah akan terus keluar dari tubuh hingga dapat mengakibatkan kematian.
Selain berperan dalam pembekuan darah, ion juga sangat penting dalam transportasi gas oksigen (O2) dan gas karbon dioksida (CO2) dalam tubuh.
Molekul
Molekul adalah gabungan antara dua atau lebih atom-atom melalui ikatan kimia tertentu. Ukuran molekul sangat kecil sehingga tidak dapat diamati dengan mata telanjang dan bahkan tidak dapat diamati dengan mikroskop biasa.
Molekul dalam Makhluk Hidup
Molekul dapat tersusun sedemikian rupa sehingga menjadi suatu struktur tertentu, misalnya rambut, tersusun dari molekul-molekul yang mengandung unsur karbon (C), hidrogen (H), nitrogen (N), dan sulfur (S). Sedangkan tulang, mengandung kalsium (Ca), fosfor (P), dan oksigen (O).
Molekul dalam Benda
Selain pada makhluk hidup, benda seperti kayu, plastik, air, udara, kain, dan benda-benda lain, juga merupakan zat kimia yang tersusun atas senyawa-senyawa tertentu. Dalam senyawa, molekul-molekul tertata sedemikian rupa sehingga memberikan sifat-sifat tertentu. Misalnya, plastik mempunyai sifat lentur karena memiliki molekul yang struktur rantainya panjang dan terdapat rongga antar rantai molekulnya.
Susunan Molekul
Selain disusun oleh molekul yang berbeda, sifat-sifat suatu materi yang berbeda juga dapat disebabkan oleh perbedaan susunan molekul-molekul dalam materi itu. Misalnya, kita ambil contoh kayu yang dibuat pensil dan pati dalam umbi kentang.
Umbi kentang (dan kebanyakan umbu-umbi lainnya mengandung pati atau amilum yang dapat kita makan dan merupakan sumber energi bagi tubuh. Pati disusun oleh molekul-molekul yang berantai panjang.
Rantai panjang tersebut disusun oleh unit-unit molekul yang lebih sederhana yang disebut glukosa. Antara molekul glukosa yang satu dengan yang lainnya dihubungkan oleh ikatan glikosida.
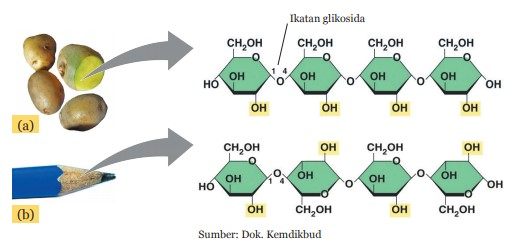
Ikatan glikosida adalah ikatan kimia yang terjadi antar molekul monosakarida atau gula sederhana. Molekul glukosa yang menyusun amilum tersusun dari atom C, H, dan O dengan perbandingan tertentu. Kayu yang digunakan untuk membuat pensil tersusun atas molekul selulosa yang juga mempunyai rantai panjang.
Molekul panjang tersebut terdiri atas molekul-molekul glukosa yang sama seperti pada pati. Apakah perbedaan antara molekul selulosa dengan pati (amilum)? Perhatikan ikatan antara dua molekul glukosanya pada gambar di atas.
Selulosa dan amilum mempunyai molekul penyusun sama yaitu glukosa, tetapi jenis ikatan yang menghubungkan antar molekul glukosanya berbeda. Pada amilum, unit-unit glukosa dihubungkan melalui ikatan α-1,4 glikosida. Pada selulosa, unit-unit glukosa dihubungkan melalui ikatan β-1,4 glikosida.
Rumus Molekul
Tiap-tiap senyawa mempunyai rumus molekul tertentu. Rumus molekul menunjukkan jenis atom yang menyusun suatu molekul dan perbandingannya. Perhatikan gambar di bawah ini.
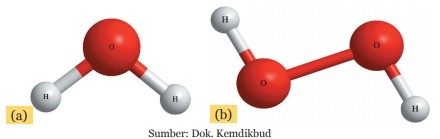
Molekul air (H2O) terdiri atas satu atom O dan dua atom H. Bila dua atom O mengikat dua atom H, maka akan terbentuk senyawa yang berbeda yaitu hidrogen peroksida (H2O2). Fenomena itu menunjukkan bahwa perbandingan jumlah dan jenis atom dalam suatu molekul akan menghasilkan senyawa yang sifat dan jenisnya sangat berbeda.
Sifat Zat dan Hubungannya dengan Partikel Penyusun dan Strukturnya
Setiap zat memiliki sifat yang unik dan berbeda dengan zat lain yang disebabkan oleh perbedaan jumlah dan jenis atom penyusun suatu zat, perbedaan ikatan, atau perbedaan struktur (susunan) atom atau molekul-molekul penyusunnya.
Contohnya, Intan dan grafit tersusun dari atom yang sama yaitu atom karbon (C), namun membentuk struktur dan jenis ikatan yang berbeda sehingga dapat dihasilkan karakteristik yang berbeda. Pada intan masing-masing atom karbon (C) mengikat empat atom karbon (C) lainnya dengan ikatan kovalen membentuk struktur tetrahedral.
Agar dapat membedakan zat penyusun suatu benda atau bahan, kita dapat mengidentifikasi sifat-sifat suatu zat. Sifat suatu zat dapat dikelompokkan menjadi sifat fisika dan sifat kimia.
Sifat Fisika
Sifat fisika merupakan sifat yang dapat diamati dengan tanpa mengubah ciri-ciri dan komposisi suatu zat dan tidak berhubungan dengan pembentukan zat baru, misalnya kerapatan, kekerasan, elastisitas, daya hantar, viskositas, kemagnetan, titik didih, titik beku, dan titik leleh (Tim Kemdikbud, 2017, hlm. 134-140).
- Kerapatan,
adalah massa zat dalam satuan volume tertentu. Satuan kerapatan adalah kg/m3 atau g/ml. Misalnya udara memiliki kerapatan 1,205 kg/m3 sedangkan gas asetilena atau gas karbid (C2H2) memiliki kerapatan 1,092 kg/m3. - Kekerasan,
merupakan ukuran untuk menentukan keras atau lunaknya suatu zat. - Elastisitas,
merupakan kemampuan suatu benda untuk mempertahankan diri ketika terkena tarikan atau dorongan (gaya) dan mampu untuk kembali ke ukuran serta bentuk awal ketika gaya tersebut dihilangkan. - Daya Hantar,
adalah kemampuan suatu zat untuk menghantarkan panas atau listrik. Berdasarkan sifat ini, benda dapat dibedakan menjadi konduktor, isolator, dan semikonduktor. - Kemagnetan,
Kemampuan suatu zat untuk dapat dipengaruhi oleh medan magnet disebut dengan sifat kemagnetan. Sifat kemagnetan dibedakan menjadi tiga, yaitu feromagnetik, paramagnetik, dan diamagnetik. - Viskositas (Kekentalan),
adalah ukuran kekentalan fluida (zat cair dan gas) yang menyatakan besar kecilnya gesekan di dalam fluida. Semakin besar viskositas suatu fluida, maka semakin sulit suatu fluida mengalir dan semakin sulit suatu benda bergerak di dalam fluida tersebut. - Titik Didih,
adalah suhu saat zat cair mulai berubah menjadi uap pada tekanan tertentu. Zat cair dapat berubah menjadi uap karena tekanan uap lebih besar dari tekanan luar yang menahan zat cair. - Titik Beku,
merupakan suhu pada tekanan tertentu saat zat cair mulai berubah menjadi padat ketika suhu suatu zat diturunkan. - Titik leleh,
adalah suhu pada tekanan tertentu saat zat padat mulai berubah menjadi cair.
Sifat Kimia
Sifat kimia adalah sifat yang tampak pada suatu zat ketika zat tersebut mengalami perubahan atau reaksi menjadi zat lain, misalnya kestabilan, korosifitas, dan kereaktifan.
- Kestabilan,
adalah kemampuan suatu zat untuk mempertahankan diri dari perubahan atau dekomposisi di lingkungan alamiahnya atau ketika terkena udara, panas, cahaya, tekanan, kondisi alami lain, atau akibat adanya reaksi alami yang dapat terjadi pada zat tersebut. - Kereaktifan,
merupakan ukuran yang menunjukkan mudah tidaknya suatu zat bereaksi dengan zat lain. - Korosifitas,
adalah kemampuan suatu zat dalam mengikis logam dan membuat logam cepat berkarat.
Referensi
- Kementerian Pendidikan dan Kebudayaan. (2017). Ilmu Pengetahuan Alam SMP/MTs Kelas VIII. Jakarta: Kementerian Pendidikan dan Kebudayaan.
Alhamdullilah, bersyukur